医療分野におけるバリュー・ベイスド・プライシングとその可能性
2011/10/11
佐藤 智晶
政策ビジョン研究センター特任助教
概要
我が国では医療イノベーション実現のために、診療報酬・薬価などにおいて費用対効果の観点を導入することや、イノベーション成果を適切に評価することが、大きな課題となっている1。他方、海外でも医薬品に関して、最も有効かつ革新的で、しかも必要とされる新薬により高い薬価をつけようという試みが今まさに進められようとしている。それが、バリュー・ベイスド・プライシング(Value Based Pricing, VBP)という制度である。本ページでは、特に英国における議論を紹介した後、我が国における論点、現時点における問題、そして今後の可能性について、特に特定保険医療材料価格の補正加算の仕組みを例にして述べる。なお、本ページは、あくまでも私の個人的な見解であり、所属機関の見解を反映するものではない。
1. 英国バリュー・ベイスド・プライシングの概要Pari PI 11 No.04
1. 計画
バリュー・ベイスド・プライシングという言葉が公式に使われるようになったのは、2010年7月に公表された英国保健省白書「公平さと卓越さ:NHSの規制緩和」(Equity and Excellence: Liberating NHS)が最初である2。同白書によれば、公的医療機関で使われる医薬品の購入価格3のあり方について、英国政府は今後バリュー・ベイスド・プライシングを段階的に導入するという。
バリュー・ベイスド・プライシングにおいて当初想定されていたのは、販売後の新薬について有効性に関する臨床データを収集し、他の類似薬との医療上の価値を比較、その後で増分費用対効果を計算して、最後に新薬の償還価格を決めるというプロセスであった4。この方法では、製薬メーカーはとりあえず新薬の販売価格を決められるものの、NHSが償還する価格が後から、当該医薬品の医療上の価値に基づいて決定されることになる。
英国では、これまで価格コントロールはそこまで強く行われていない。すなわち、英国では今のところ、製薬メーカーが医薬品の価格を自由に決定できる一方、その利益率を制限する自主的な規制が行われている(Pharmaceutical Price Regulation Scheme, PPRS)。 具体的な規制の内容は、次のとおりである5。第1に、製薬メーカーは自社の製品に対して価格を自由に設定することができる。しかし第2に、製薬メーカーの業界団体と英国保健省の自主協定により、製薬メーカーの対売り上げ利益率が8.4%を超えた場合、その超過分を現金の払い戻しや値下げを通じて、保健省に対して償還することとなっている。第3に、製薬メーカーはこのような自主規制の仕組みに参加しないこともできるものの、その場合には保健省によって薬価が決められる。保健省が定める薬価は一般的に低いため、ほとんどの製薬メーカーは先に説明した仕組みに参加する。
このような現行の規制に代わるものとして、同白書は、バリュー・ベイスド・プライシングを新たに導入するというわけである。新薬の価値に基づいて価格付けを行うということは、一方では医療上の価値をエビデンスで証明できるならば今までの利益幅に限定されることなく高い薬価(償還価格)がつくのに対し、他方で価値を証明できない限り、今まで自分たちが自由に決められていた価格よりも低い償還価格が付くことさえありうる。それでもなお、英国保健省がバリュー・ベイスド・プライシングを推進しようとするのは、現行の制度では製薬メーカーの価格設定の自由が保障される一方で、イノベーションや患者の新薬へのアクセスが必ずしも向上しないからである6。ここでは、NHSが医療上の利益で正当化されないような高い価格を新薬購入のために製薬メーカーに支払う場合や、そもそもNHSが高価な新薬を購入できなくなり、新薬へのアクセスが制限される場合が想定されている。
2010年の英国保健省白書によれば、バリュー・ベイスド・プライシングの恩恵は、患者と医療制度の双方に及ぶという。すなわち、患者にとっては、NHS(国民医療保健サービス)における有効な医薬品と革新的な治療法に対するよりよいアクセスが保障されるとともに、NHSにとっては、薬剤費の支出に見合った価値を確保できるだろう、と予想されているのである7。このようなバリュー・ベイスド・プライシングという制度は、2014年1月に施行される8。
英国保健省は、治療成績と医療の質に着目して医療サービスが提供されなければならないとしており、そこで具体的に想定されているのは、死亡率と罹患率を低下させ、安全性を高め、さらには患者にとってよりよい医療サービスである。先に挙げた白書によれば、医療サービスの向上のために、まずは全英で目指すべき治療成績や医療の質(national outcome goals)について議論し、その後で現在利用可能な最善のエビデンスで、目標達成の評価指標(indicators)を決めることになっている。しかも、その目標達成の評価指標は、英国国立最適保健医療研究所(National Institute for Health and Clinical Excellence, NICE)で定められる医療の質に関する基準を反映するものとされた9。NHS憲章10によれば、NHSでは尊重と尊厳、医療の質、慈悲、生活の改善、患者との共同、すべての人が重要であることの6つが、追求すべき価値として規定されていたものの、今回の白書では、医療において評価されるべき価値がより具体的に、かつ、診療報酬や薬価に結びつけられる形で言及されているのである。
2. 問題点
英国では、増分費用対効果比率(Incremental Cost Effectiveness Ratio, ICER)を用いて医薬品の価値を計るのが一般的であるが、そこでいう「効果」の計算や、既存の類似薬との差別化が、製薬メーカーにとって悩ましい問題とされる11。
まず、効果についてである。英国国立最適保健医療研究所は、「QALY」という基準を採用している。QALYとは、“Quality Adjusted Life Year”の略で、生活の質を考慮した生存年のことをいう。この基準で医療を評価すると、1単位あたりのQALYを生み出す費用が小さければ小さいほど、ある医療は優れていることになる。英国国立最適保健医療研究所は、一単位あたりのQALYを生み出す費用について、特別の理由なしにおおむね2万から3万ポンドという上限値を設けていると言われているが、対象患者数が少ない小児の病気や希少疾病についてどう扱うのか、精神病や慢性病のように生存年よりも生活の質が主に問題となる場合にどう適用すべきなのか、という問題がある。このように医療上の価値の定義が狭く解され、その他の価値が適切に評価されないとすれば、製薬メーカーとしては定義に合わない新薬については、それを求める一定の患者や医師がいたとしても、開発しにくくなってしまう12。
もう1つの問題は、特許が切れていない医薬品同士について、何をもって類似性を判断し、価格付けをするべきなのかというものである。仮に、新薬開発のインセンティヴとして一定の価格プレミアムを認めるとした場合、既存の医薬品と比べてどの程度優れていることを要件とするのか、それをどのようなエビデンスで証明すればよいのか、そして追加的な有効性がどの程度のプレミアムに値するのかが明らかでないと、製薬メーカーは新薬開発を躊躇しかねない。他方でNHSとしては、できる限り予算を効率的に使おうとすれば、さほど比較有効性を持たない新薬に価格プレミアムを支払うべきではないことになる。そのため、NHSは、十分なエビデンスがない限り、既存薬に近づけて新薬の価格を考えるに違いない。
このように、そもそも新薬の効果として評価される対象が限定的にしか認められておらず、しかもどのようなデータによって比較有効性ありと認めるのか、その比較有効性がどれだけの価格プレミアムに値するのかという点が不透明だと、新薬の開発、導入、利用促進が進みにくくなるという問題が、少なくとも指摘されている。
2. 議論すべき論点と今後の可能性
先に紹介した英国の試みは、世界各国で繰り広げられている試行錯誤の一例に過ぎず、我が国でも医療イノベーション推進のために、医薬品だけでなくそれ以外の医療技術についても、いわゆるバリュー・ベイスド・プライシングの可能性を模索することになるだろう。なぜならば、バリュー・ベイスド・プライシングは、その具体的内容については幅がありうる考え方であるが、その核心として診療報酬、薬価、特定保険材料価格などで、おのおのの医療行為、製品、技術のイノベーションを適切に評価することを基礎にしているからである。以下では、我が国でバリュー・ベイスド・プライシングをさらに検討する場合の論点と、現時点における可能性についてまとめてみたい。可能性については、特に特定保険医療材料価格の補正加算の仕組みを例にして説明する。
1. 論点
今後、バリュー・ベイスド・プライシングをさらに検討するにあたっては、次の点が少なくとも論点になる。もっとも、バリュー・ベイスド・プライシングという考え方自体は、後述するようにすでに我が国でも部分的に導入されているものであり、下記の論点は整理のために列挙しているに過ぎない。
- 何を医療上の価値、医療イノベーションとして扱うのか。
- 医療上の価値、医療イノベーションを評価するための指標およびエビデンス
- 関連するエビデンスの集め方、エビデンスの評価方法
- 診療報酬や薬価などにおける医療イノベーションに対するインセンティヴのあり方(インセンティヴの財源を含む)
- エビデンスの質やレベルとインセンティヴとの間の関連づけ
2. 現時点における問題
バリュー・ベイスド・プライシングという考え方に立つとすれば、我が国の特定保険医療材料価格の算定について、次の2つの点は少なくとも十分に検討される必要がある。第1に、類似機能別というバスケットごとに材料価格が決められてしまう点。第2に、英米独仏4カ国の外国平均価格のみによって、材料価格が価格調整され、上限が1.5倍に制限されてしまう点である。どちらも、それぞれの医療機器がどのような医療上の価値を持つかに十分に着目することなく、価格が決定されてしまう仕組みではないかという懸念がある。このような点について検討するために、まず簡単に、現在の新規材料の価格算定ルールを確認する13。
新規材料の価格算定ルールの概要
特定保険医療材料の価格設定は、基本的に薬価算定のルールを準用している。新規材料の価格算定のルールには、類似機能区分比較方式と、原価計算方式の2つが設けられているのに対し、新医薬品の薬価算定ルールの場合には、類似機能区分ではなく類似薬の有無で算定ルールが分けられており、類似薬がない場合に原価計算方式が適用されるからである。新規材料の場合、類似機能区分がすでにある場合には類似機能区分比較方式が、ない場合には原価計算方式が適用されている。もっとも、特定保険医療材料の場合には、銘柄別ではなく類似機能別のバスケットで価格が設定されることから、薬価算定のルールとは完全に同じではない。類似機能別に価格が設定されてしまうと、それぞれの新規材料について医療上の価値を適切に評価することが実際には難しくなる。
また、新規材料の価格算定のルールで特筆すべきは、最終的に外国平均価格の1.5倍を超える場合には1.5倍に相当する額にキャップが設けられている点である。英国、米国、ドイツ、フランスの医療材料の価格を相加平均した額と比較して、このような価格調整が行われることになる。
補正加算の仕組み
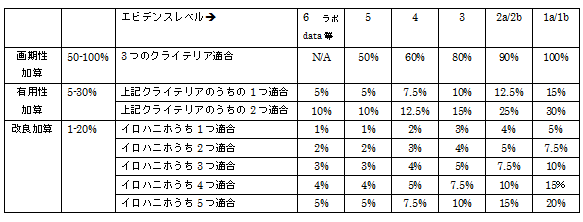
我が国の現行制度のもとで、バリュー・ベイスド・プライシングの考え方が部分的に採用されているのは、補正加算の仕組みについてであろう。類似機能区分比較方式で価格算定される場合、画期性加算、有用性加算、改良加算、そして市場性加算というそれぞれの価格補正が用意されている。それぞれの補正加算には要件が設けられており、それを満たした場合に価格が補正される。各加算要件に示されているのが、医療上の価値が認められる場合ということになり、それを何らかのエビデンスで証明したときにはじめて、価格の補正を受けることができるのである。
補正加算の仕組みの問題点
補正加算の仕組みにおける問題は、各要件を満たしていることを証明するエビデンスについて十分な説明がないことと、エビデンスの種類やレベルと加算範囲が結びつけられていないことである。各補正加算のなかで画期性加算(50%〜100%)、有用性加算(5%〜30%)、改良加算(1〜20%)には、それぞれ加算要件と補正範囲が設けられている。しかしながら、要件を満たしていることをどのようなエビデンスで示せばよいのか、そしてどのようなレベルのエビデンスを提出すれば、どのレベルの価格補正をしてもらえるのかが事前に明らかではない。新規材料の価格算定に際して不明確な点が大きければ大きいほど、価格予見可能性が低いことにより、医療機器メーカーが新規材料の開発と導入に消極的になる可能性がある。また、補正加算を受けた材料価格は、当然ながら最終的に外国平均価格による価格調整の対象となる。この際、せっかく評価された特定保険医療材料のバリューが無視または帳消しにされるようだと、メーカーとして新規材料を導入しにくくなることは言うまでもない。
加えて、価格の算定に際しては、販売時と販売後の双方の場面を想定しておく必要がある。なぜならば、薬事承認を受けた新規材料をはじめて日本で販売する場合に、その時点で必ずしも十分なエビデンスを揃えられるとは限らない。医薬品と異なり、医療機器の場合には、販売承認時までに必ずしもたくさんの有効性データを集められるわけではない。機器によっては少数のデータしか集めようがない場合がある。
3. 今後の可能性
現在、我が国でもバリュー・ベイスド・プライシングに向けた動きがある。薬価や医療材料価格について、医療経済学的な観点が考慮されようとしているのである。たとえば、革新的な製品の価格算定に際し、イノベーションの評価とともに費用対効果の観点を導入することや、導入する場合の考え方について検討してはどうか、という見解が出されはじめた。そこでは、外国事例も参考にしながら、具体的な評価方法等の検討や検証が進められるべきという意見もある。中長期的には、英国をはじめとする諸外国の例を参考にして、我が国なりの制度を新たに構築してゆくことになるだろう。
より短期的には、現行の制度のもとでバリュー・ベイスド・プライシングをどうやって模索するべきか、という点も問題になる。以下では、特定保険医療材料を一例にして、現時点における可能性について言及する。なお、保険医療材料は、診療報酬項目において包括的に評価されているものと(A区分)、そうでないもの(B区分およびC区分)、そもそも保険適用に馴染まないものに区分されている。ここでは、B区分とC区分を念頭におく。
具体的な可能性の案
- おのおのの新医療機器の価値を適切に評価するために、他の既存製品の機能類似性についてはより丁寧に、より予見可能な形で判断する可能性
- 「有効性に関するエビデンスの種類、量、レベル」と「補正加算レベル」を適切に関連づける可能性
- 市販後調査に基づいて価格を増減させるメカニズムの可能性
- たとえば、新規材料価格の算定において暫定的なプレミアムを認める一方、一定期間後に比較有効性を示す追加データの提出がない場合には、再算定時に既存材料と同様に扱うような仕組み、または、当初の価格算定において既存材料として扱われる場合には、一定期間後に比較有効性を示す追加データの提出があれば、事後的にプレミアムを認める仕組みの可能性
- 費用対効果の観点を医療イノベーションとして評価する場合には、加算要件リストのどこかに医療の経済性に関する項目を入れる可能性
参考までに上記の可能性(案)の2については、概要を本ページの下部にまとめておく。
3. 結びにかえて
バリュー・ベイスド・プライシングという考え方は、根本的に新しいものではないのかもしれないが、世界的にみてもこれまで全面的な導入に成功した国はない。特に医療機器を含む医療技術についてはいえば、議論ははじまったばかりである。医薬品については英国で議論が先行しているものの、医療イノベーションを推進しようとする我が国では、短期的は現行制度のもとで、中長期的には諸外国の制度に照らして、何らかのバリュー・ベイスド・プライシングを検討してゆくことになるだろう。その際には、医薬品と医療機器との間の違いのように、個別の医療関連製品の特性に鑑みることはもちろんのこと、そもそも何を医療上の価値とするのか(何を医療上のイノベーションとするのか)、イノベーションの計り方やそこで用いられるエビデンスとはどんなものか、そしてどうやってイノベーションの促進にインセンティヴをつけてゆくのかを議論することが避けられない。医療の質を高めつつ医療費の増大を抑えるような、より費用対効果の高い医療を実現する診療報酬・薬価制度を模索するために、バリュー・ベイスド・プライシングに向けて今後さまざまな試行錯誤が期待される。
エビデンスの種類とレベル
- a. ランダム化比較試験のメタアナリシス
- b. 少なくとも一つのランダム化比較試験
- a. ランダム割付を伴わない同時コントロールを伴うコホート研究(前向き研究,prospective study,concurrent cohort studyなど)
- b. ランダム割付を伴わない過去のコントロールを伴うコホート研究(historical cohort study,retrospective cohort studyなど)
- ケース・コントロール研究(後ろ向き研究)
- 処置前後の比較などの前後比較,対照群を伴わない研究
- 症例報告,ケースシリーズ
- 専門家個人の意見(専門家委員会報告を含む)
現行制度上の画期性および有用性加算の要件リスト
- 臨床上有用な新規の機序を有する医療機器であること
- 類似機能区分に属する既収載品に比して、高い有効性又は安全性を有することが、客観的に示されていること
- 当該新規収載品により、当該新規収載品の対象となる疾病又は負傷の治療方法の改善が客観的に示されていること
現行制度上の改良加算の要件リスト
- 構造等における工夫により、類似機能区分に属する既収載品に比して、医療従事者への高い安全性を有することが、客観的に示されていること。
- 類似機能区分に属する既収載品に比して、当該新規収載品の使用後における廃棄処分等が環境に及ぼす影響が小さいことが、客観的に示されていること。
- 構造等の工夫により、類似機能区分に属する既収載品に比して、患者にとって低侵襲な治療をできることが、客観的に示されていること。
- 小型化、軽量化等の工夫により、それまで類似機能区分に属する既収載品に比して、小児等への適用の拡大が、客観的に示されていること。
- 構造等の工夫により、類似機能区分に属する既収載品に比して、より安全かつ簡易な手段が可能となること等が、客観的に示されていること。
- たとえば、内閣官房医療イノベーション推進室「医療イノベーションの目指す方向性」2011年6月16日; 内閣府・文部科学省・厚生労働省・経済産業省「革新的医薬品・医療機器創出のための5か年戦略の概要」(2009年2月改定)
- それ以前に使われた例として、UK Office of Fair Trading, The Pharmaceutical Price Regulatory Scheme, February 2007
- 公的医療機関で使われる医薬品の販売に対して製薬会社に支払われるべき額
- See, e.g., UK House of Parliament: Parliamentary Office of Science & Technology, Postnote, No. 364, Oct. 2010, at 3
- たとえば、竹之下泰志「イギリスの医療制度−費用対効果向上への取り組み」(2007年12月8日)を参照
- Department of Health, Medicines, Pharmacy & Industry Group, Use A new value-based approach to the pricing of branded medicines: a consultation, Dec. 16, 2010, at 9
- Department Health, Equity and Excellence: Liberating NHS (July, 2010) at 26
- See, e.g., UK Department of Health, NICE: frequently asked questions on 8, Last modified on Nov. 18, 2010
- バリュー・ベイスド・プライシングにおけるNICEの役割については、see NICE, Value based pricing: response to the Department of Health consultation, March 2011, Mar., 2011, at 12
- NHS, The NHS Constitution for England, March 8, 2010 at 12
- See, e.g., Panos Kanavos, et al., Implementing value-based pricing for pharmaceuticals in the UK, 2020health org., Mar., 2010, at Ch. 5
- See, e.g., Sten Stovall, Interview: UK Pharma Braced For Fresh Value-Based Pricing Talks, Wall St. J., Aug. 24, 2011
- 中央社会医療保険協議会総会「参考資料2−1」(2011年8月24日)を参照


